
江苏省高考化学新增分大一轮复习 专题11 物质结构与性质 第35讲 原子结构与元素性质课件 苏教版-苏教版高三全册化学课件.pptx

文库****坚白








亲,该文档总共76页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料
江苏省高考化学新增分大一轮复习 专题11 物质结构与性质 第35讲 原子结构与元素性质课件 苏教版-苏教版高三全册化学课件.pptx
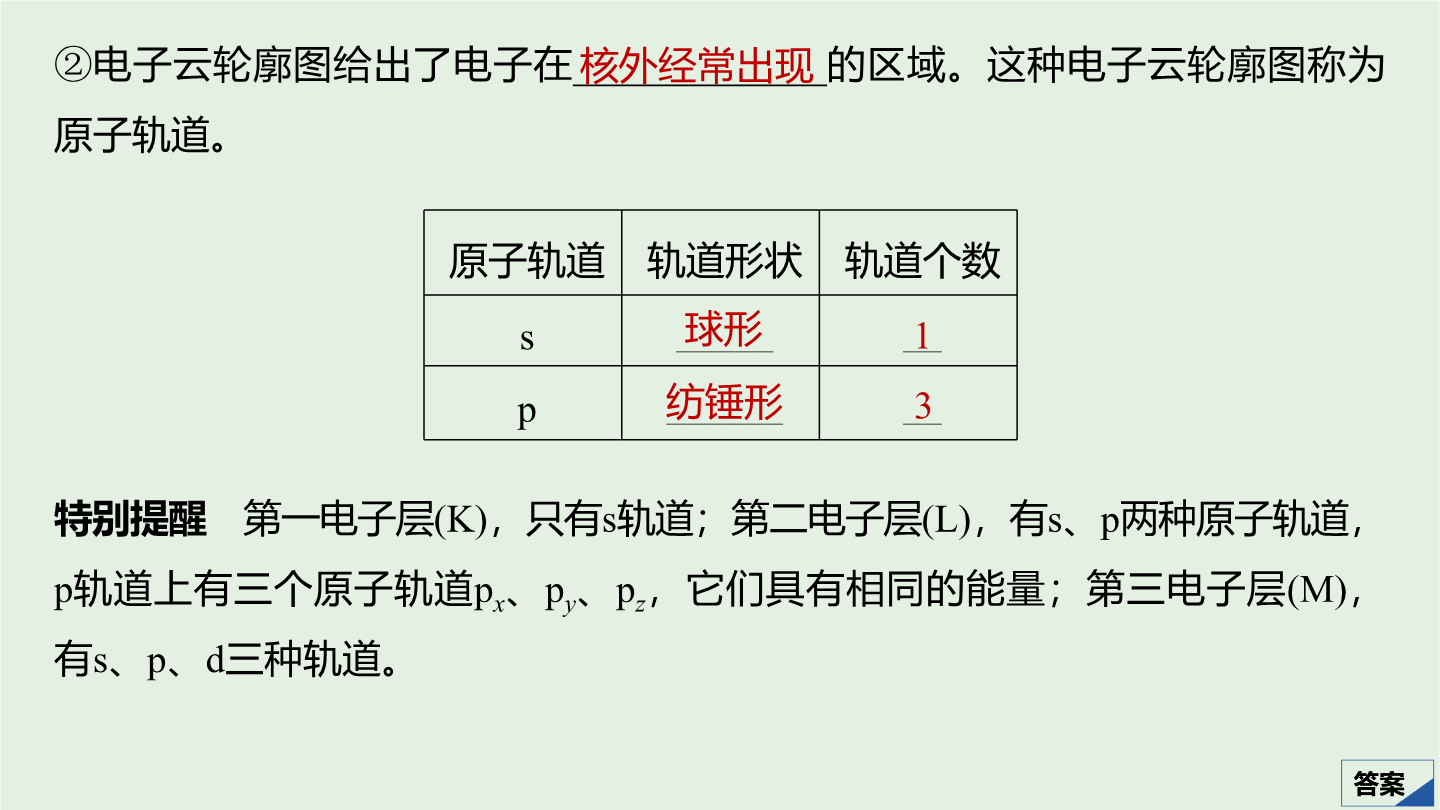
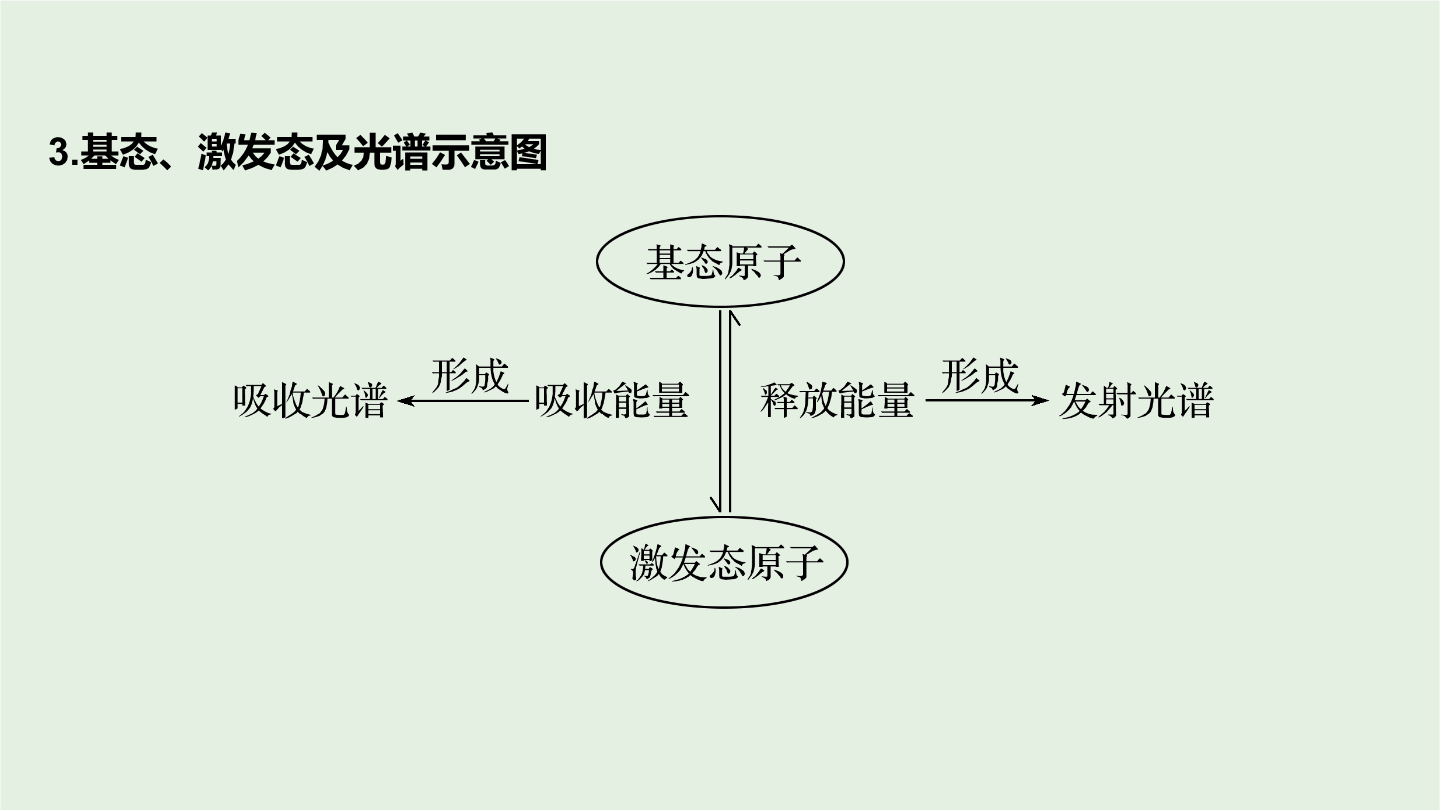
考点一原子核外电子排布原理1.电子层、原子轨道原子轨道2.基态原子的核外电子排布注意所有电子排布规则都需要满足能量最低原理。(2)泡利不相容原理每个原子轨道里最多只能容纳__个电子且自旋状态_____。如2s轨道上的电子排布为不能表示为。(3)洪特规则当电子排布在同一能级的不同轨道时基态原子中的电子总是_________占据一个轨道且自旋状态相同。如2p3的电子排布为不能表示为或。洪特规则特例:当能量

高考化学复习 专题12 物质结构与性质 第1讲 原子结构与元素的性质课件 苏教版-苏教版高三全册化学课件.pptx
专题十二物质结构与性质第1讲原子结构与元素的性质考纲要求:1.了解原子核外电子的运动状态、能级分布和排布原理能正确书写1~36号元素原子核外电子、价电子的电子排布式和电子排布图。(宏观辨识与微观探析)2.了解电离能的含义并能用以说明元素的某些性质。(宏观辨识与微观探析)3.了解电子在原子轨道之间的跃迁及其简单应用。(证据推理与模型认知)4.了解电负性的概念并能用以说明元素的某些性质。(证据推理与模型认知)-4--5--6--7--8--9--10--11--12--13--14--15--16-

高考化学复习 专题12 物质结构与性质 第3讲 晶体结构与性质课件 苏教版-苏教版高三全册化学课件.pptx
第3讲晶体结构与性质考纲要求:1.了解晶体的类型了解不同类型晶体结构中微粒、微粒间作用力的区别。(宏观辨识与微观探析)2.能根据离子化合物的结构特征解释其物理性质。(证据推理与模型认知)3.了解晶格能的概念了解晶格能对离子晶体性质的影响。(宏观辨识与微观探析)4.了解分子晶体结构与性质的关系。(证据推理与模型认知)5.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。(证据推理与模型认知)6.了解金属晶体常见的堆积方式。(宏观辨识与微观探析)7.了解晶胞的概念能根据晶胞确

高考化学复习 专题12 物质结构与性质 第3讲 晶体结构与性质课件 苏教版-苏教版高三全册化学课件.pptx
第3讲晶体结构与性质考纲要求:1.了解晶体的类型了解不同类型晶体结构中微粒、微粒间作用力的区别。(宏观辨识与微观探析)2.能根据离子化合物的结构特征解释其物理性质。(证据推理与模型认知)3.了解晶格能的概念了解晶格能对离子晶体性质的影响。(宏观辨识与微观探析)4.了解分子晶体结构与性质的关系。(证据推理与模型认知)5.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。(证据推理与模型认知)6.了解金属晶体常见的堆积方式。(宏观辨识与微观探析)7.了解晶胞的概念能根据晶胞确

高三化学一轮复习 专题8 第36讲 原子结构与性质课件 苏教版-苏教版高三全册化学课件.ppt
专题八物质结构与性质(选考)第36讲原子结构与性质知识体系课前思考课前思考课前8min课前8minO210O>N>C>H>GaA同周期元素随核电荷数依次增大原子半径逐渐减小考点透视能层概率密度交错能量最低原理吸收光或发射光的波长和频率2ds失去一个电子所需的最低能量原子中用于形成化学键的电子减小主族序数C>质量验收A15
