
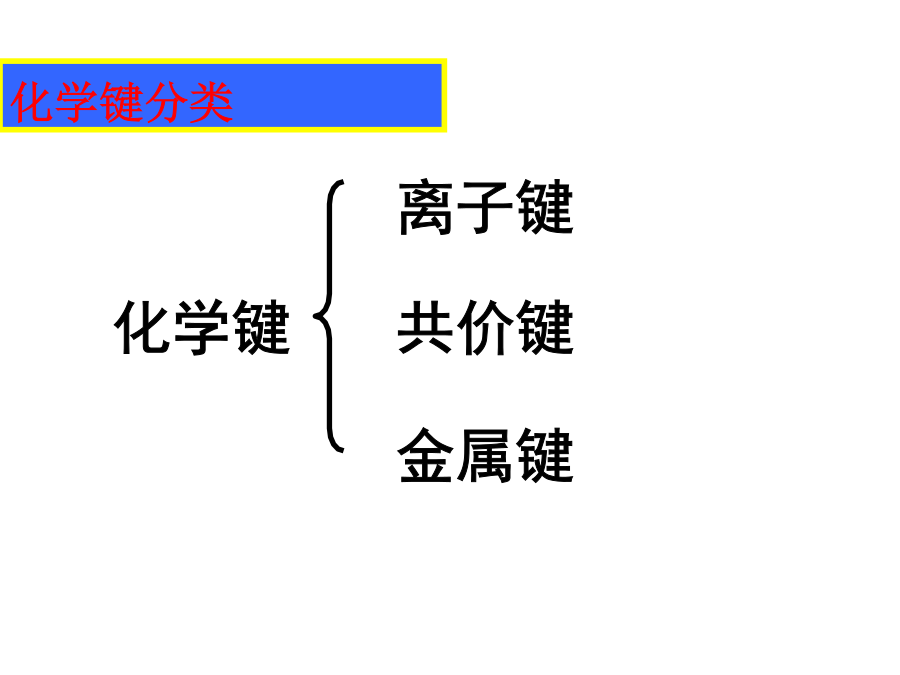
离子键_离子晶体课件.ppt

ys****39






亲,该文档总共54页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料
离子键_离子晶体课件.ppt
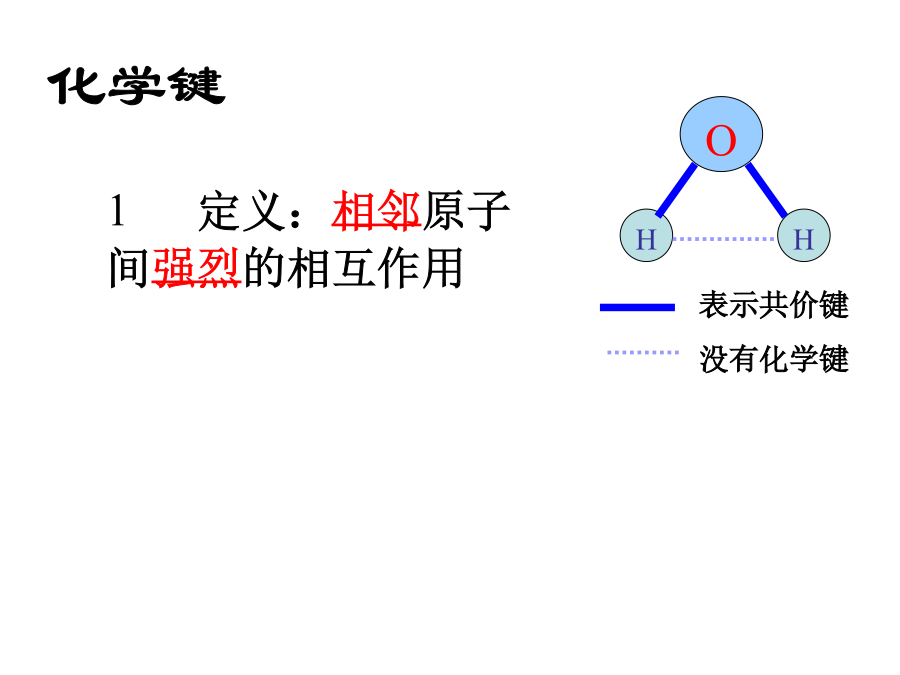
教学目标:O2。用化学键的观点来分析化学反应的本质是什么?化学键+17电子得失形成阴、阳离子。二、离子键离子半径大小比较规律1、阳离子半径<相应的原子半径;如:Na+<Na2、阴离子半径>相应的原子半径;如:Cl->Cl3、同一主族元素,从上到下,离子半径逐渐增大;如:Li+<Na+<K+F-<Cl-<Br-<I-4、具有相同电子层结构的离子,核电荷数越多离子半径越小如:O2->F->Na+>Mg2+比较下列物质的熔沸点,用“>”或“<”填空:注意:下列化合物中含有离子键()5。离子化合物:含有离子键的化

专题三 离子键 离子晶体 一离子键的形成课件.pptx
会计学教学目标1、理解离子键及其离子键的形成过程。2、能用电子式表示离子化合物的形成过程。3、掌握影响离子键强弱的因素。4、理解离子晶体的概念、构成及物理性质。5、掌握常见的离子晶体的类型。一、离子键的形成根据元素的金属性和非金属性差异,你知道那些原子之间能形成离子键?钠原子与氯原子是如何结合形成氯化钠的?你能用电子式表示氯化钠的形成过程吗?1.形成离子键的主要原因3、离子化合物注意:1、金属元素不一定能形成离子化合物,如:AlCl3、BeCl2。因金属活泼性弱,难失电子。2、离子化合物中不一定含金属元素

离子键和离子晶体 PPT课件.ppt
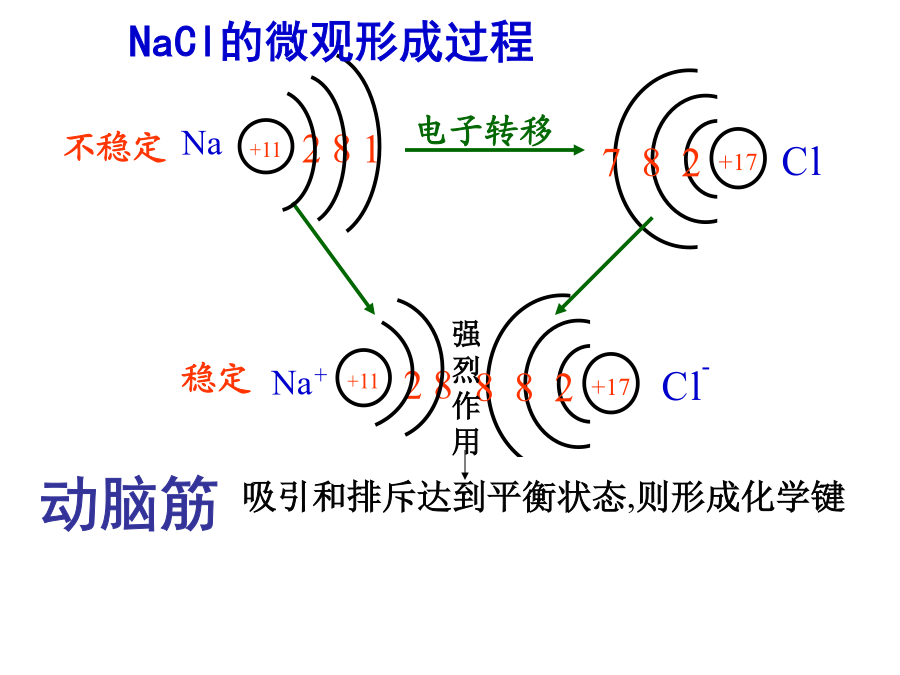
第二单元离子键离子晶体钠原子与氯原子是如何结合形成氯化钠的?你能用电子式表示氯化钠的形成过程吗?根据元素的金属性和非金属性差异,你知道那些原子之间能形成离子键?1.形成离子键的主要原因离子键1.下列化合物中含有离子键()3、离子键与离子化合物1.书写下列物质的电子式教科书P35大家学习辛苦了,还是要坚持重晶石BaSO4莹石CaF2胆矾CuSO4·5H2O食盐NaCl常温常压下,离子化合物大多数以晶体的形式存在。通过学习有关离子键和离子晶体的知识,你知道构成离子晶体的微粒是什么吗?离子晶体中微粒间的作用是什

离子键离子晶体.ppt
1、离子键的定义:使带相反电荷的阴、阳离子结合的相互(静电)作用静电作用指:在离子化合物中,阴、阳离子之间的静电引力使阴、阳离子相互吸引;阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。Na离子成键的主要原因:活泼金属最外层电子数少于4个,容易失去最外层电子而使次外层达到8个电子的稳定结构;活泼非金属最外层电子数多于4个,容易获得电子而使最外层达到8个电子的稳定结构。两者化合时,通过电子的转移形成结构相对稳定、电性相反的阴、阳离子,当阴、阳离子之间
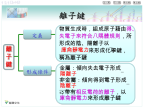
离子键与离子晶体.ppt
離子鍵動畫:金屬與非金屬的浪漫婚禮氯化鈉的形成離子鍵的形成(NaCl為例)鈉與氯的反應氟化鈉的形成氯化鎂的形成陰、陽離子不斷靠近時,彼此間是否永遠只有吸引力?解:不是的,當陰、陽離子靠近時仍會出現兩離子間電子與電子、原子核與原子核間的斥力。典型元素形成離子典型元素形成離子時的電荷量1A族與7A族元素以離子鍵鍵結時,陽、陰離子各帶多少電荷呢?解:1A族形成+1價陽離子7A族形成-1價陰離子氫原子與其他元素化合時,若從其他元素獲得一個電子,氫也可以有與氦氣相同的電子排列。若氫以離子鍵與1A或2A族元素化合時,
