
【南方凤凰台】2014届高考化学总复习 专题六 化学反应速率和化学平衡 课时29 化学反应速率 影响化学反应速率的因素检测与评估.doc

新月****姐a






在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

【南方凤凰台】2014届高考化学总复习 专题六 化学反应速率和化学平衡 课时29 化学反应速率 影响化学反应速率的因素检测与评估.doc
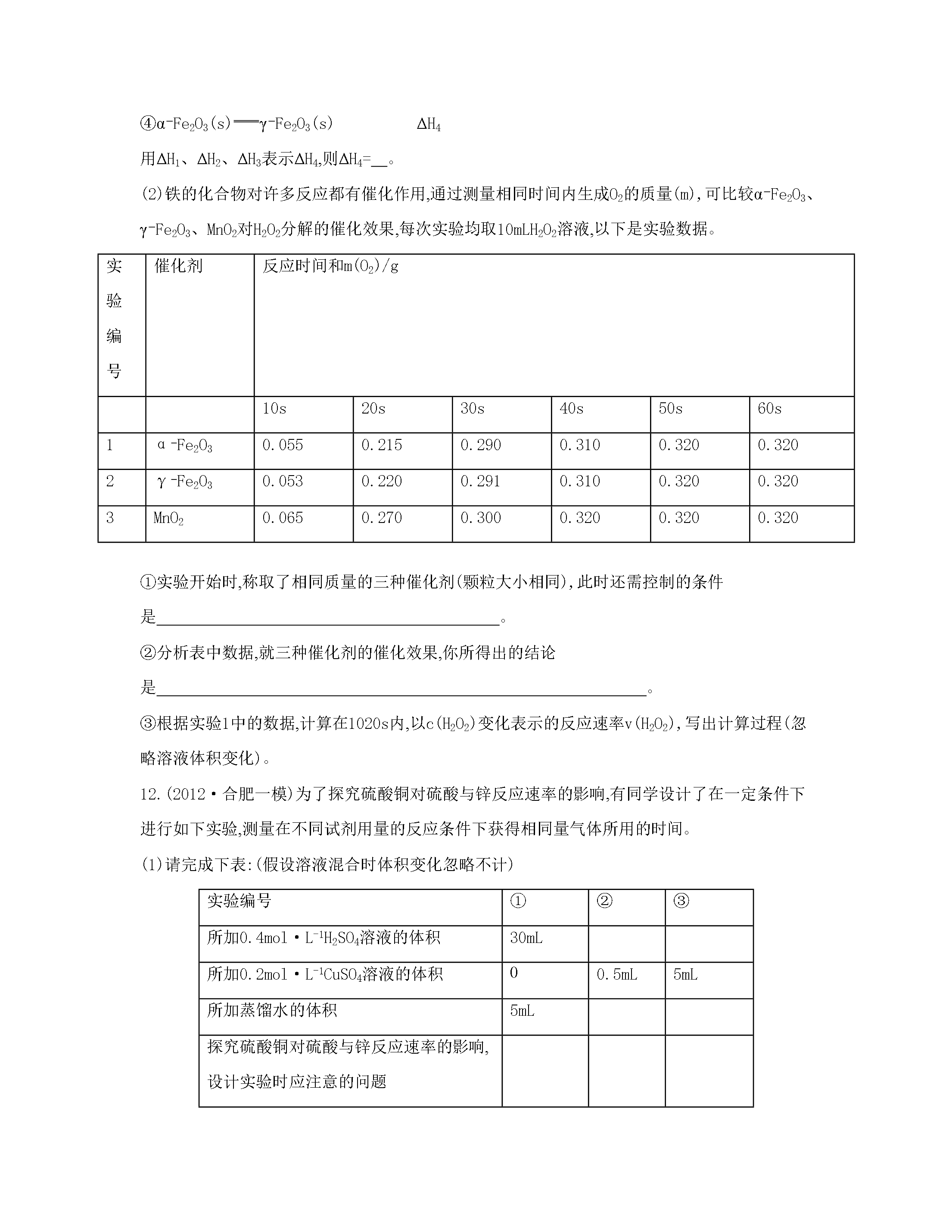
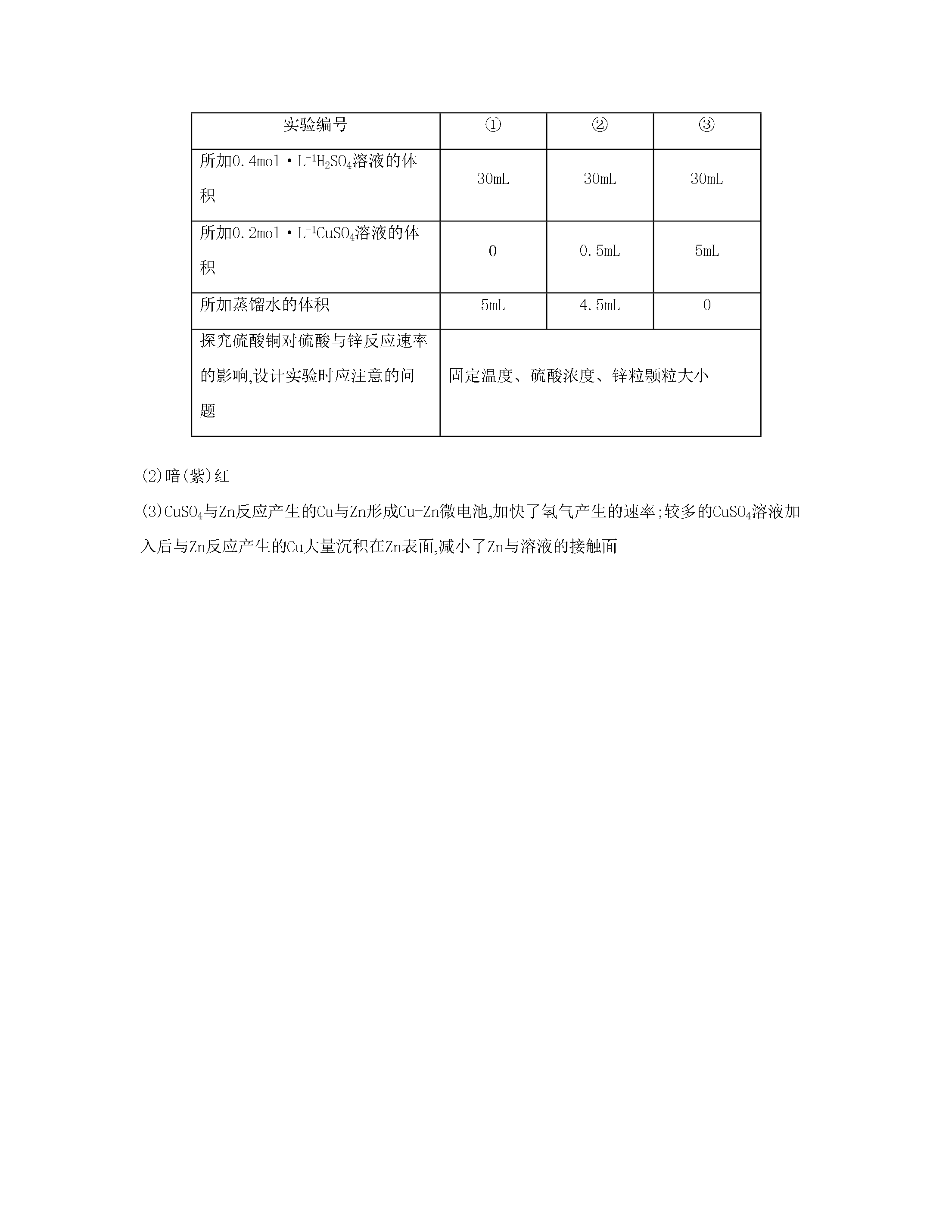
专题六化学反应速率和化学平衡课时29化学反应速率影响化学反应速率的因素一、单项选择题1.对于反应3W(g)+2X(g)4Y(g)+3Z(g),下列反应速率关系中,正确的是()A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X)2.NO和CO都是汽车尾气中的有害物质,按以下反应处理:2NO(g)+2CO(g)N2(g)+2CO2(g)。对该反应的下列叙述正确的是()A.使用催化剂不能加快反应速率B.降低压强能加快反应速率C.升高温度能加快反应速率D.改变压强对

【南方凤凰台】2014届高考化学总复习 专题六 化学反应速率和化学平衡 课时29 化学反应速率 影响化学反应速率的因素检测与评估.doc
专题六化学反应速率和化学平衡课时29化学反应速率影响化学反应速率的因素一、单项选择题1.对于反应3W(g)+2X(g)4Y(g)+3Z(g)下列反应速率关系中正确的是()A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X)2.NO和CO都是汽车尾气中的有害物质按以下反应处理:2NO(g)+2CO(g)N2(g)+2CO2(g)。对该反应的下列叙述正确的是()A.使用催化剂不能加快反应速率B.降低压强能加快反应速率C.升

南方凤凰台2021届高考化学总复习专题六化学反应速率和化学平衡课时29化学反应速率影响化学反应速率的.doc
专题六化学反应速率和化学平衡课时29化学反应速率影响化学反应速率的因素一、单项选择题1.对于反应3W(g)+2X(g)4Y(g)+3Z(g),下列反应速率关系中,正确的是()A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X)2.NO和CO都是汽车尾气中的有害物质,按以下反应处理:2NO(g)+2CO(g)N2(g)+2CO2(g)。对该反应的下列叙述正确的是()A.使用催化剂不能加快反应速率B.降低压强能加快反应速率C.升高温度能加快反应速率D.改变压强对

2014届高考化学总复习专题检测评估 专题六 化学反应速率和化学平衡 课时29 化学反应速率 影响化学反应速率的因素.doc
专题六化学反应速率和化学平衡课时29化学反应速率影响化学反应速率的因素一、单项选择题1.对于反应3W(g)+2X(g)4Y(g)+3Z(g),下列反应速率关系中,正确的是()A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X)2.NO和CO都是汽车尾气中的有害物质,按以下反应处理:2NO(g)+2CO(g)N2(g)+2CO2(g)。对该反应的下列叙述正确的是()A.使用催化剂不能加快反应速率B.降低压强能加快反应速率C.升高温度能加快反应速率D.改变压强对

【南方凤凰台】2014届高考化学总复习 专题六 化学反应速率和化学平衡 课时31 影响化学平衡的因素检测与评估.doc
课时31影响化学平衡的因素一、单项选择题1.(2012·深圳中学)对于达到平衡的可逆反应X+YW+Z,增大压强得正、逆反应速率(v)的变化如右图所示,分析可知X、Y、Z、W的聚集状态可能是()A.Z、W为气体,X、Y中之一为气体B.Z、W中之一为气体,X、Y为非气体C.X、Y、Z皆为气体,W可能是气体,也可能为非气体D.X、Y为气体,Z、W中有一种为气体2.(2012·连云港模拟)T℃时,A、B、C三种气体在反应过程中浓度变化如图1所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系
