
高考化学二轮复习 专题七 电化学课件 新人教版-新人教版高三全册化学课件.ppt

是湛****21









亲,该文档总共102页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学二轮专题复习 专题七 电化学课件-人教版高三全册化学课件.pptx
专题七电化学变式十九大报告中提出要“打赢蓝天保卫战”意味着对大气污染防治比过去要求更高。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合原理如图7-3所示。下列说法正确的是()A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极B.Pt1电极附近发生的反应为SO2+2H2O-2e-=H2SO4+2H+C.Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-D.相同条件下放电过程中消耗的SO2和O2的体积比为2∶12.金属腐蚀快慢的三个规律(1)金属腐

高考化学二轮专题复习 专题七 电化学课件-人教版高三全册化学课件.pptx
专题七电化学变式十九大报告中提出要“打赢蓝天保卫战”意味着对大气污染防治比过去要求更高。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合原理如图7-3所示。下列说法正确的是()A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极B.Pt1电极附近发生的反应为SO2+2H2O-2e-=H2SO4+2H+C.Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-D.相同条件下放电过程中消耗的SO2和O2的体积比为2∶12.金属腐蚀快慢的三个规律(1)金属腐

高考化学二轮复习 专题七 电化学课件 新人教版-新人教版高三全册化学课件.ppt
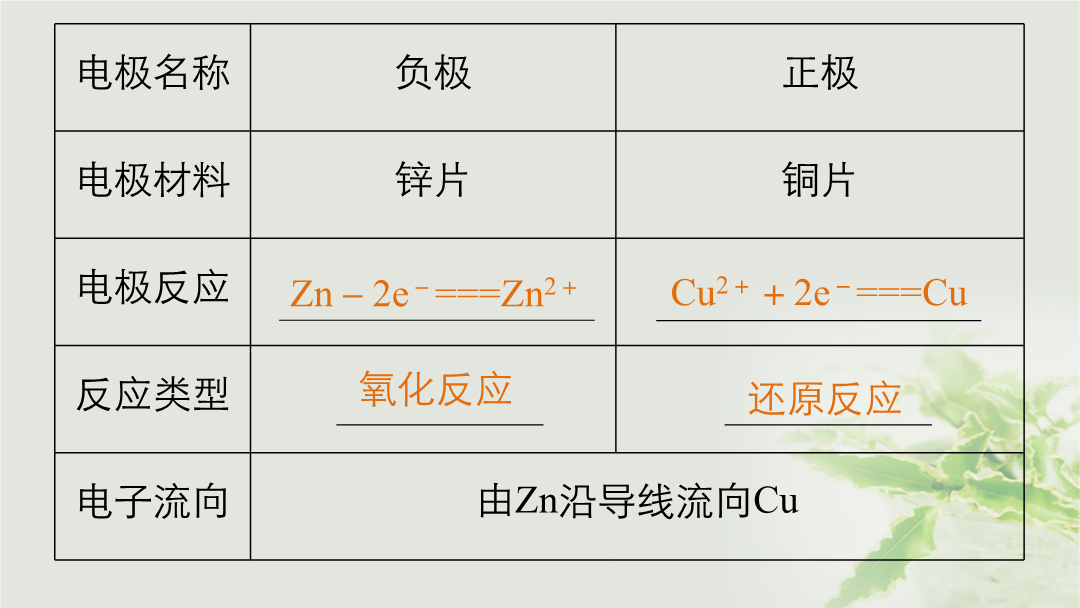
专题七电化学1.理解原电池和电解池的工作原理能写出电极反应式和电池反应方程式;了解常见化学电源的种类及其工作原理。2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害和防止金属腐蚀的措施。考点一原电池原理的全面突破1.通常只有能自发进行的氧化还原反应才能设计成原电池。2.工作原理以锌铜原电池为例:电极名称盐桥中离子移向说明(1)无论是装置Ⅰ还是装置Ⅱ电子均不能通过电解质溶液。(2)在装置Ⅰ中由于不可避免会直接发生Zn+Cu2+===Cu+Zn2+而使化学能转化为热能所以装置Ⅱ的能量转化率高。1.[2

高考化学二轮复习 专题七 电化学课件 新人教版-新人教版高三全册化学课件.ppt
专题七电化学1.理解原电池和电解池的工作原理能写出电极反应式和电池反应方程式;了解常见化学电源的种类及其工作原理。2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害和防止金属腐蚀的措施。考点一原电池原理的全面突破1.通常只有能自发进行的氧化还原反应才能设计成原电池。2.工作原理以锌铜原电池为例:电极名称盐桥中离子移向说明(1)无论是装置Ⅰ还是装置Ⅱ电子均不能通过电解质溶液。(2)在装置Ⅰ中由于不可避免会直接发生Zn+Cu2+===Cu+Zn2+而使化学能转化为热能所以装置Ⅱ的能量转化率高。1.[2

高考化学二轮复习 专题六 电化学课件-人教版高三全册化学课件.ppt
专题六
