
(江苏选考)新高考化学一轮复习 专题5 微观结构与物质的多样性 2 第二单元 元素周期表与元素周期律教学案 苏教版-苏教版高三全册化学教学案.doc

猫巷****松臣









亲,该文档总共21页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(江苏选考)新高考化学一轮复习 专题5 微观结构与物质的多样性 2 第二单元 元素周期表与元素周期律教学案 苏教版-苏教版高三全册化学教学案.doc
第二单元元素周期表与元素周期律学习任务1元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号。原子序数=核电荷数=核外电子数。2.元素周期表的编排原则3.元素周期表的结构(1)周期(7个横行7个周期)短周期长周期周期序数1234567元素种数288181832320族元素原子序数21018365486118(2)族(18个纵行16个族)主族列序121314151617族序ⅠAⅡAⅢAⅣAⅤAⅥAⅦA副族列序345671112族序ⅢBⅣBⅤBⅥBⅦBⅠBⅡBⅧ族第8、9、10共3个纵行0族第1

(江苏选考)新高考化学一轮复习 专题5 微观结构与物质的多样性 1 第一单元 原子结构教学案 苏教版-苏教版高三全册化学教学案.doc
第一单元原子结构学习任务1原子结构同位素1.人类对原子结构的认识道尔顿原子结构模型→汤姆生原子结构模型→卢瑟福原子结构模型→玻尔原子结构模型→电子云模型2.原子的构成3.构成原子和离子的各粒子间关系(1)质子数=核电荷数=原子序数=核外电子数。(2)质量数(A)=质子数(Z)+中子数(N)。(3)阳离子的核外电子数=质子数-阳离子所带电荷数。(4)阴离子的核外电子数=质子数+阴离子所带电荷数。4.微粒符号周围数字的含义5.元素、核素、同位素6.同分异构体、同素异形体、同位素概念辨析同分异构体同素异形

(江苏选考)新高考化学一轮复习 专题5 微观结构与物质的多样性 3 第三单元 微粒之间的相互作用与物质的多样性教学案 苏教版-苏教版高三全册化学教学案.doc
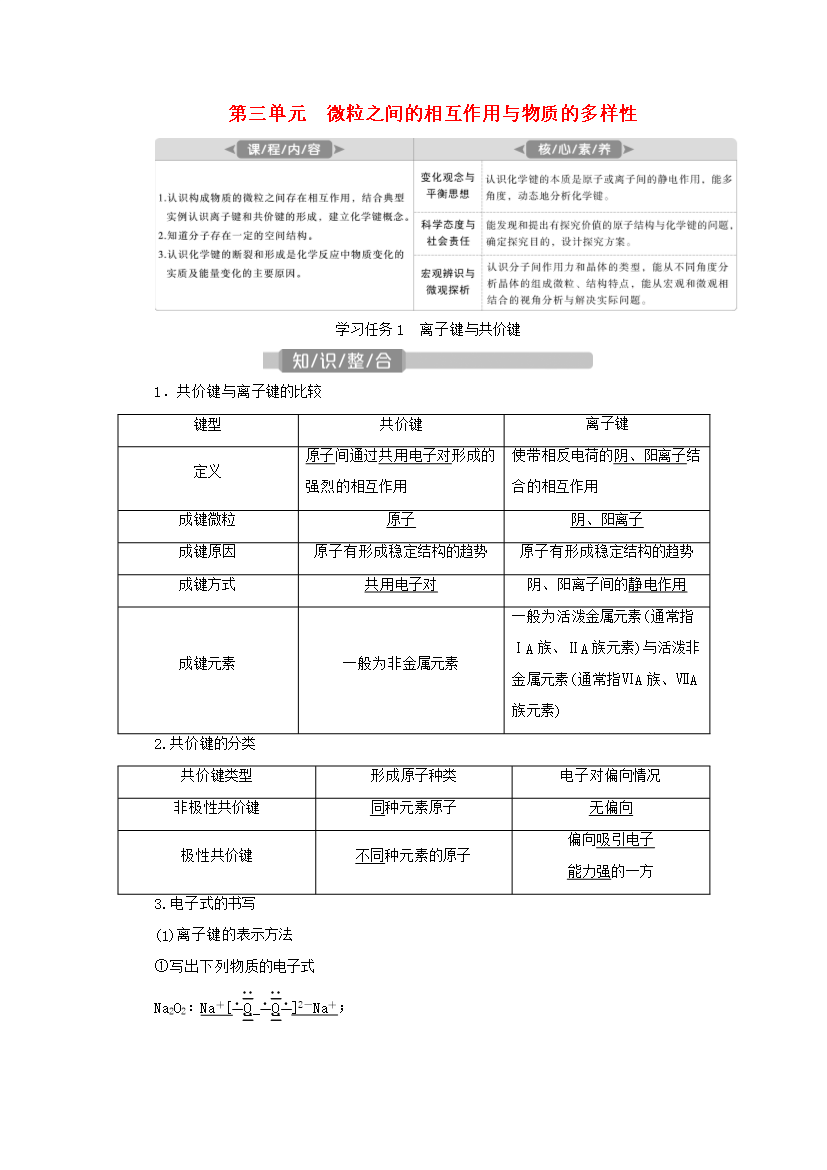
第三单元微粒之间的相互作用与物质的多样性学习任务1离子键与共价键1.共价键与离子键的比较键型共价键离子键定义原子间通过共用电子对形成的强烈的相互作用使带相反电荷的阴、阳离子结合的相互作用成键微粒原子阴、阳离子成键原因原子有形成稳定结构的趋势原子有形成稳定结构的趋势成键方式共用电子对阴、阳离子间的静电作用成键元素一般为非金属元素一般为活泼金属元素(通常指ⅠA族、ⅡA族元素)与活泼非金属元素(通常指ⅥA族、ⅦA族元素)2.共价键的分类共价键类型形成原子种类电子对偏向情况非极性共价键同种元素原子无偏向极性共价键

(江苏选考)新高考化学一轮复习 专题5 微观结构与物质的多样性 4 规范答题模板2 简答题中化学用语的规范书写教学案 苏教版-苏教版高三全册化学教学案.doc
规范答题模板2简答题中化学用语的规范书写[掌握规则规范答题赢取满分]典例导引(2017·高考海南卷)X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:(1)X与L组成的最简单化合物的电子式为________。(2)X与M组成的物质为________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为_________________________________________。(3)Y在周期表
(江苏选考)新高考化学一轮复习 专题5 微观结构与物质的多样性 3 第三单元 微粒之间的相互作用与物质的多样性教学案 苏教版-苏教版高三全册化学教学案.doc
第三单元微粒之间的相互作用与物质的多样性学习任务1离子键与共价键1.共价键与离子键的比较键型共价键离子键定义原子间通过共用电子对形成的强烈的相互作用使带相反电荷的阴、阳离子结合的相互作用成键微粒原子阴、阳离子成键原因原子有形成稳定结构的趋势原子有形成稳定结构的趋势成键方式共用电子对阴、阳离子间的静电作用成键元素一般为非金属元素一般为活泼金属元素(通常指ⅠA族、ⅡA族元素)与活泼非金属元素(通常指ⅥA族、ⅦA族元素)2.共价键的分类共价键类型形成原子种类电子对偏向情况非极性共价键同种元素原子无偏向极性
