 预览加载中,请您耐心等待几秒...
预览加载中,请您耐心等待几秒...

1/10

2/10
3/10

4/10
5/10
6/10

7/10

8/10

9/10

10/10
亲,该文档总共34页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
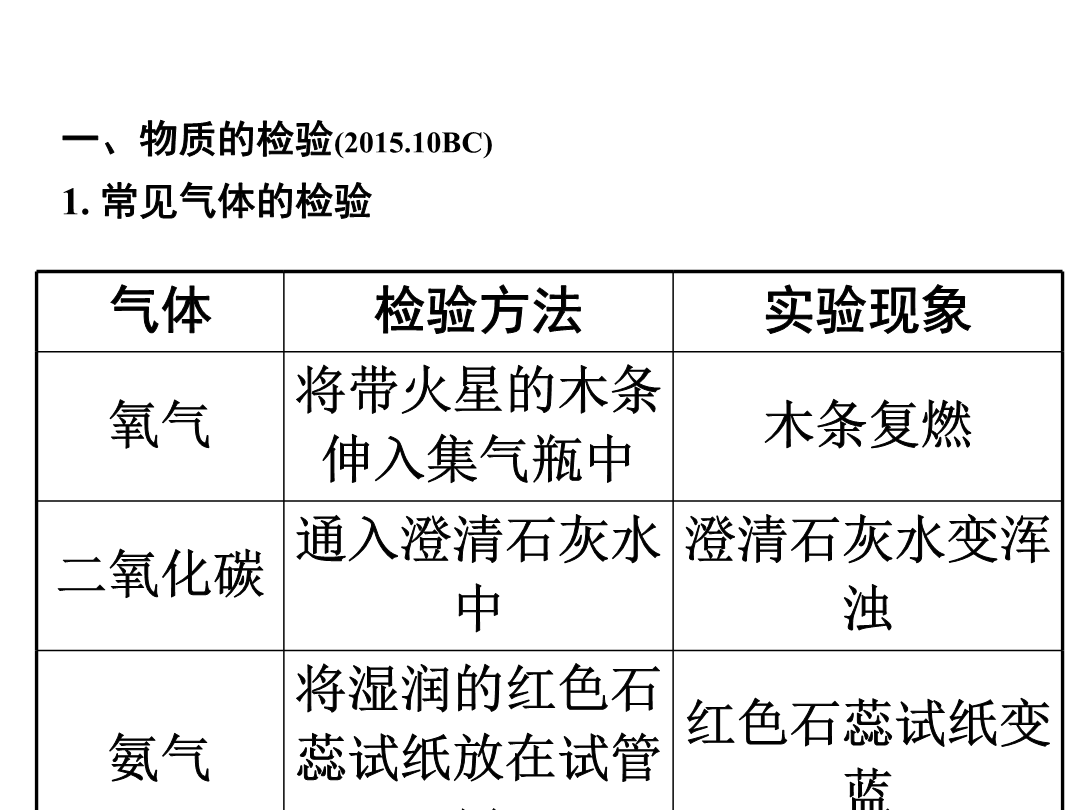
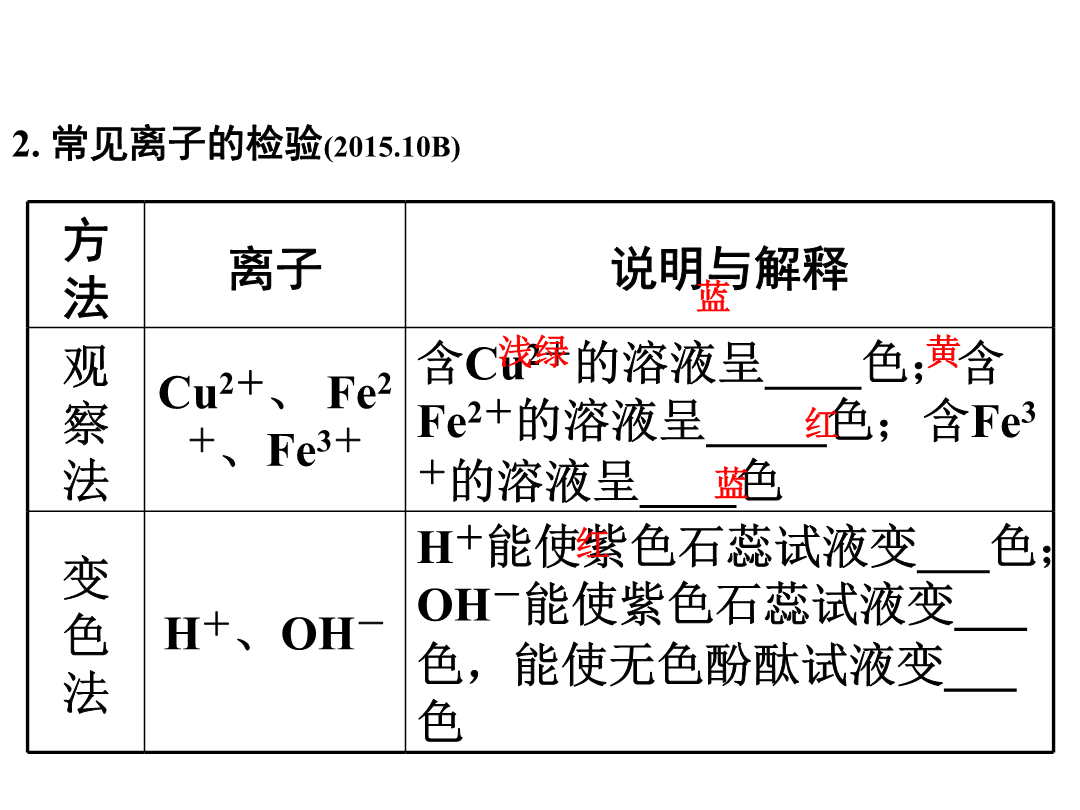
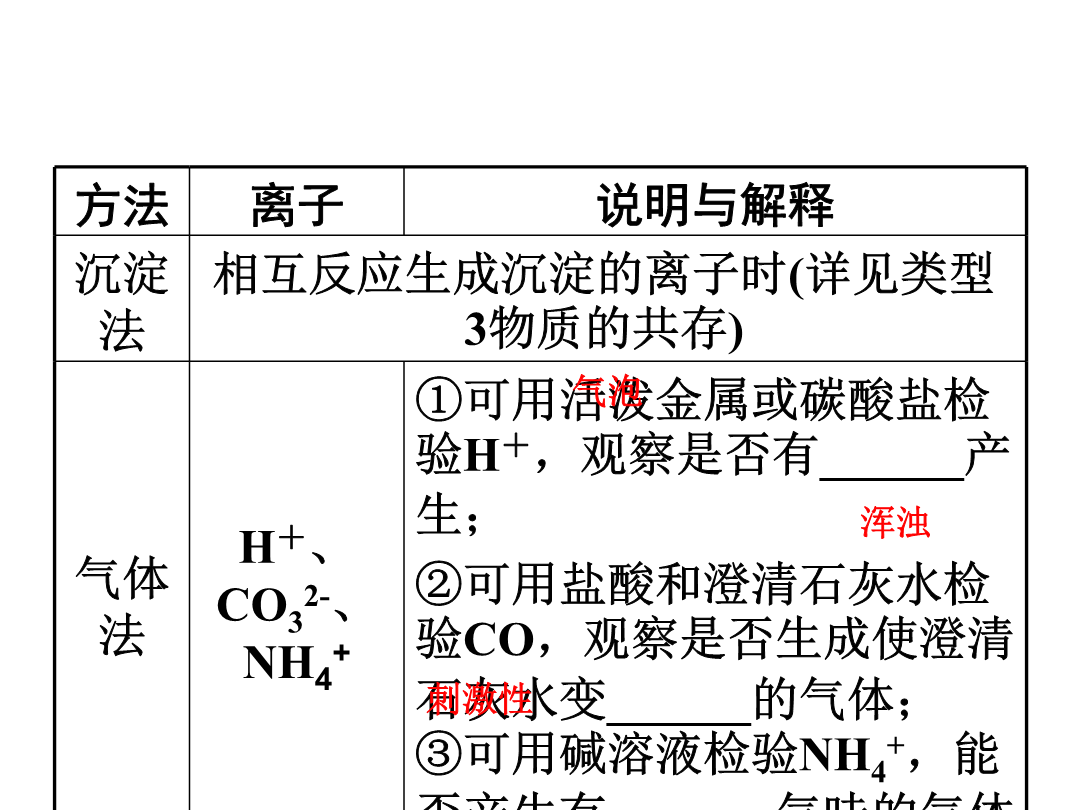
第二部分重点专题突破类型1一、物质的检验(2015.10BC)1.常见气体的检验气体2.常见离子的检验(2015.10B)方法二、物质的鉴别(2016.7;2015.10D;2014.14;2012.4)1.方法:对比两种物质的性质,寻找差异性。2.一般原则:方法选择应先简后繁,即首先分析能否根据色、态、味、溶解性等物理性质上的明显差异来区分,然后再考虑化学性质中有特征现象的反应来区分。3.鉴别步骤(化学方法)(1)取样(取少量固体或液体或气体于试管或烧杯或集气瓶中)。(2)操作(包括所用试剂及鉴别过程)。(3)现象(操作过程中可能出现的现象)。(4)结论(根据现象分析得出结论),即“先取样,后操作;先现象,后结论”。4.常见物质的鉴别(2016.7)物质物质例1(2016遵义)下列有关物质的鉴别方案错误的是()A.用水鉴别炭粉和二氧化锰B.用闻气味的方法鉴别白酒和白醋C.用澄清石灰水鉴别氮气和二氧化碳D.用相互刻画的方法鉴别黄铜片和铜片【思路分析】类型22.初中常见物质的除杂分为三类:气体除杂、液体除杂、固体除杂(1)气体除杂(2017.9A;2015.10A;2011.9A)根据物质的性质差异选用固体或液体除杂试剂。方法一:将杂质气体通过物质吸收、反应除去,如氧气中的水蒸气可通过浓硫酸吸收除去、一氧化碳中的二氧化碳可通过氢氧化钠吸收除去;方法二:将杂质气体转化为主气体,如二氧化碳中的一氧化碳可通过灼热的氧化铜,使一氧化碳转化成二氧化碳。【常见气体除杂举例】(2)固体除杂(2017.9C;2013.8D;2012.7AD;2011.9BD)方法一:将杂质转化为气体除去,如氧化铜中的炭粉通过在空气中灼烧除去;方法二:将杂质转化为溶液除去,如铜中的铁可通过与盐酸反应除去。【常见固体除杂举例】主物质(3)液体除杂(2017.9BD;2013.8ABC;2011.9C)液体之间的除杂,一般为酸、碱、盐之间的除杂,其实质为溶液中阴阳离子的除杂。(以除去NaCl中少量杂质Na2CO3为例)①先确定被提纯物质和杂质所含的离子:NaCl(Na+、Cl-),Na2CO3(Na+、CO32-);②确定杂质离子,即被提纯物质中不含有的离子CO32-;③先确定除杂试剂的一种离子,即与CO不能共存的离子:H+、Ca2+、Ba2+;④确定除杂试剂的另一种离子,不能引入其他离子,则另一种离子为Cl-;⑤确定除杂试剂:将确定的阴阳离子结合,即HCl、CaCl2、BaCl2。【常见液体除杂举例】主物质主物质例2(2017遵义)除去下列物质中少量杂质(括号内为杂质)的方法,叙述正确的是()A.一氧化碳(二氧化碳)——通过灼热的氧化铜B.水(植物油)——加洗洁精,搅拌振荡C.Na2CO3(NaHCO3)固体——充分加热至固体质量不变D.NaCl溶液(CaCl2)——滴加适量K2CO3溶液、过滤类型32.初中化学阶段常见的不共存离子如下(1)结合生成沉淀CaCO3:Ca2+—CO32-BaCO3:Ba2+—CO32-AgCl:Ag+—Cl-BaSO4:Ba2+—SO42-Cu(OH)2:Cu2+—OH-Mg(OH)2:Mg2+—OH-(2)结合生成气体气体CO2:H+—CO32-、H+—HCO3-(2015.7D)气体NH3:NH4+—OH-(3)结合生成水:H+—OH-3.物质共存中的隐含条件(1)“酸性”(或pH<7):溶液中一定存在H+,该溶液中没有能与H+反应的物质(或离子)。常见的叙述有:酸性溶液、pH=1(pH<7)的溶液、能使紫色石蕊试液变红的溶液等。(2)“碱性”(或pH>7):溶液中一定存在OH-,该溶液中没有能与OH-反应的物质(或离子)。常见的叙述有:碱性溶液、pH=11(pH>7)的溶液、能使紫色石蕊试液变蓝或能使无色酚酞试液变红的溶液等。(3)“无色”:溶液中没有以下物质或离子。①蓝色溶液⇔含Cu2+的溶液,如CuSO4、Cu(NO3)2、CuCl2等;(2015.7B)②浅绿色溶液⇔含Fe2+的溶液,如FeSO4、Fe(NO3)2、FeCl2等;③黄色溶液⇔含Fe3+的溶液,如Fe2(SO4)3、Fe(NO3)3、FeCl3等;(2015.7C)④紫红色溶液⇔含MnO的溶液,如KMnO4溶液。例3(2017苏州)下列各组离子在水溶液中能大量共存的是()A.Cu2+、Na+、NO3-、OH-B.H+、K+、CO32-、Cl-C.Mg2+、NH4+、OH-、SO42-D.Na+、Ca2+、NO3-、Cl-请完成练习册

















