
2014高考化学 专题精讲 物质的组成、性质和分类(pdf) 新人教版.rar

论文****可爱






在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

2014高考化学 专题精讲 物质的组成、性质和分类(pdf) 新人教版.rar
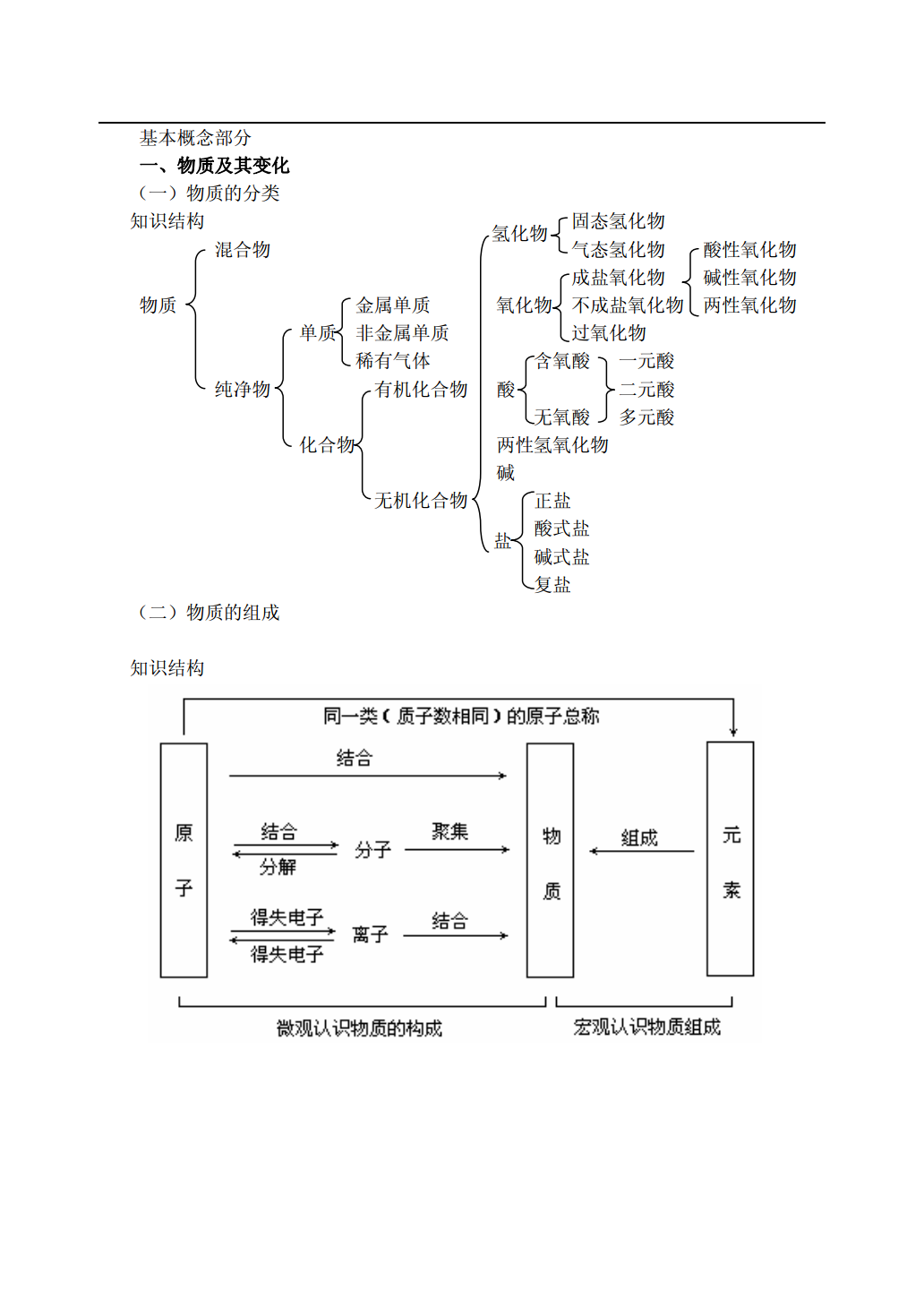
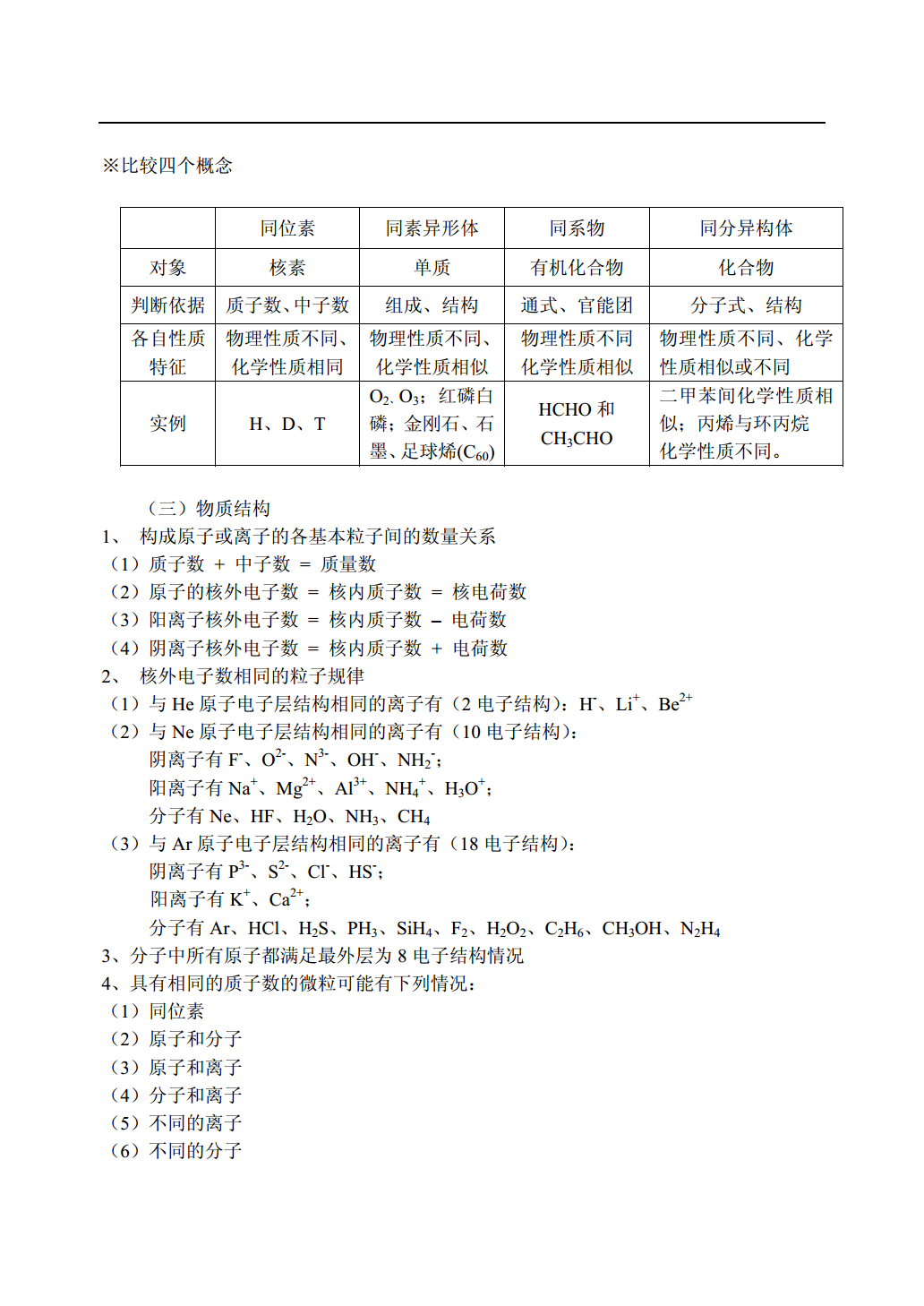
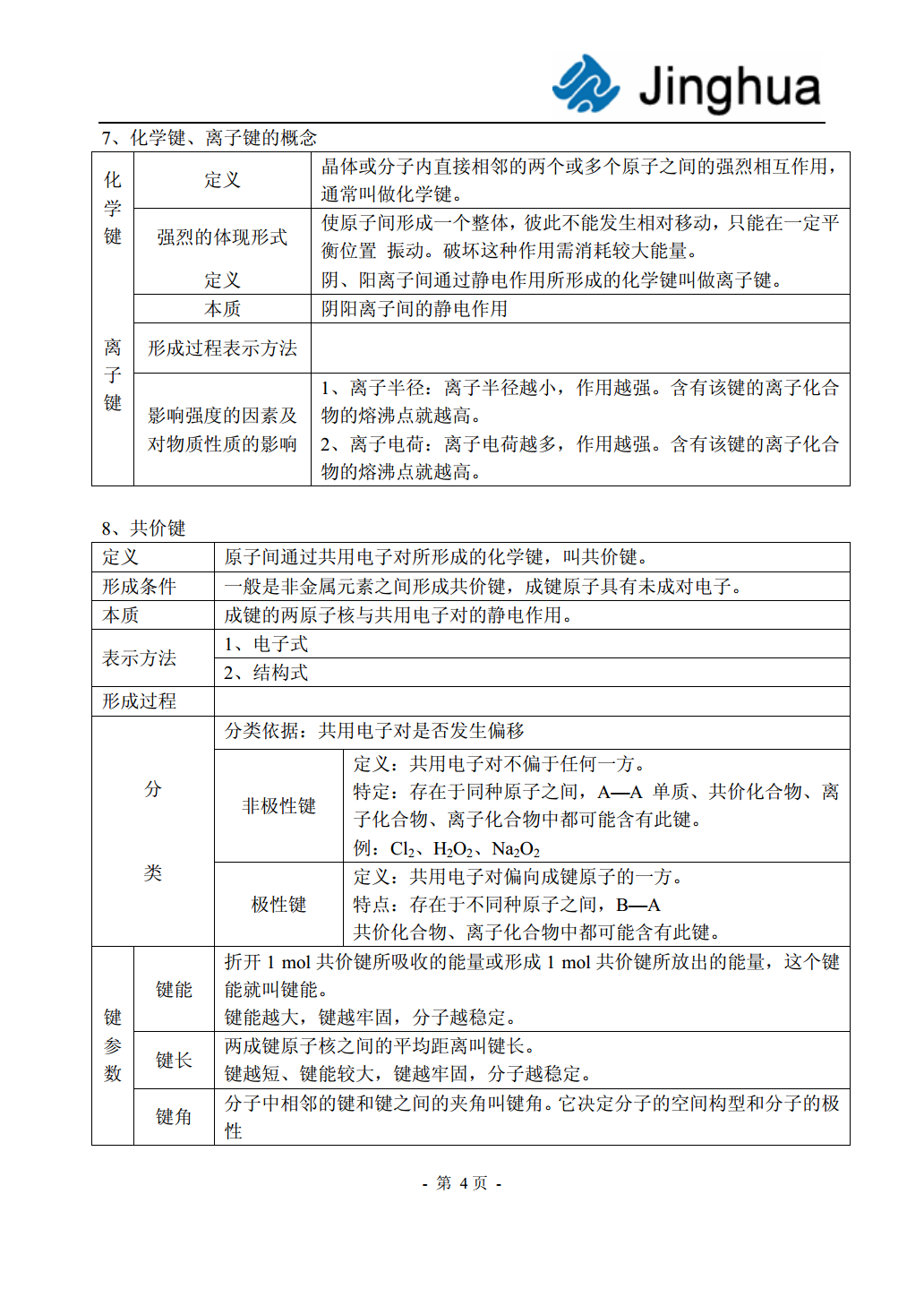
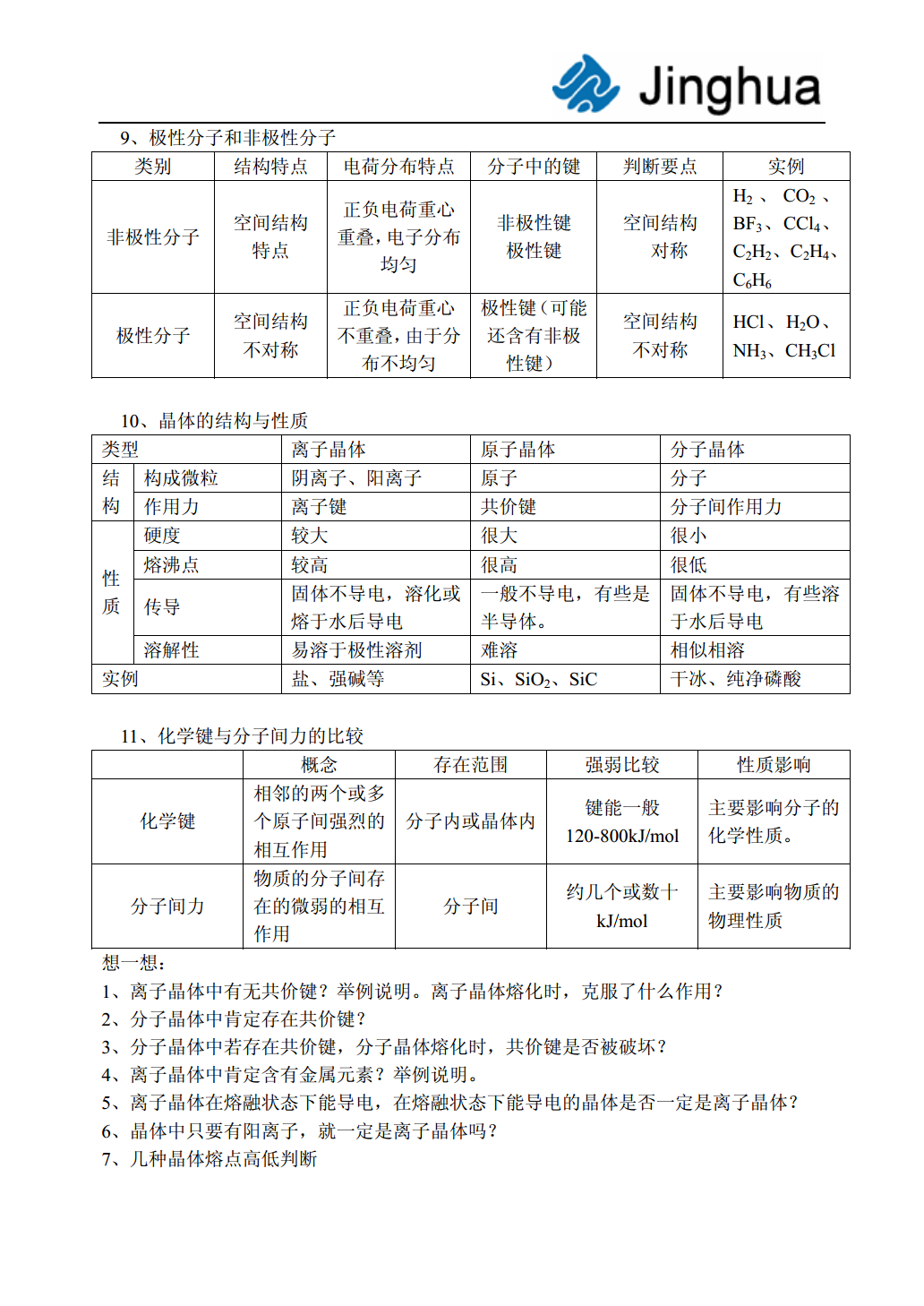
物质的组成、性质和分类教师:刘廷阁基本概念部分一、物质及其变化(一)物质的分类知识结构固态氢化物氢化物混合物气态氢化物酸性氧化物成盐氧化物碱性氧化物物质金属单质氧化物不成盐氧化物两性氧化物单质非金属单质过氧化物稀有气体含氧酸一元酸纯净物有机化合物酸二元酸无氧酸多元酸化合物两性氢氧化物碱无机化合物正盐酸式盐盐碱式盐复盐(二)物质的组成知识结构※比较四个概念同位素同素异形体同系物同分异构体对象核素单质有机化合物化合物判断依据质子数、中子数组成、结构通式、官能团分子式、结构各自性质物理性质不同、物理性质不同、物

2014高考化学 专题精讲 物质的组成、性质和分类(pdf) 新人教版.pdf
物质的组成、性质和分类

2014高考化学 专题精讲 物质的组成、性质和分类(pdf) 新人教版.pdf
物质的组成、性质和分类

2014高考化学专题复习训练:物质的组成、性质和分类 新人教版.doc
训练2物质的组成、性质和分类一、单项选择题1.下列事实与胶体性质无关的是()A.水泥厂和冶金厂常用高压直流电除去大量烟尘减少对空气的污染B.将植物油倒入水中用力搅拌形成油水混合物C.一束平行光线射入蛋白质溶液里从侧面可以看到一条光亮的通路D.氢氧化铁胶体中滴入稀硫酸先看到红褐色沉淀生成而后沉淀溶解2.下列说法正确的是()A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡和氯化铵分别属于非电解质、强电解质和弱电解质C.Mg、Al、Cu可以分别用置换法、直接加热法和电

2014高考化学专题复习训练:物质的组成、性质和分类 新人教版.doc
训练2物质的组成、性质和分类一、单项选择题1.下列事实与胶体性质无关的是()A.水泥厂和冶金厂常用高压直流电除去大量烟尘减少对空气的污染B.将植物油倒入水中用力搅拌形成油水混合物C.一束平行光线射入蛋白质溶液里从侧面可以看到一条光亮的通路D.氢氧化铁胶体中滴入稀硫酸先看到红褐色沉淀生成而后沉淀溶解2.下列说法正确的是()A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡和氯化铵分别属于非电解质、强电解质和弱电解质C.Mg、Al、Cu可以分别用置换法、直接加热法和电
