
2020高考化学二轮复习 专题 化学工艺流程分析课件.pptx

Wi****m7







亲,该文档总共17页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

2020高考化学二轮复习 专题 化学工艺流程分析课件.pptx
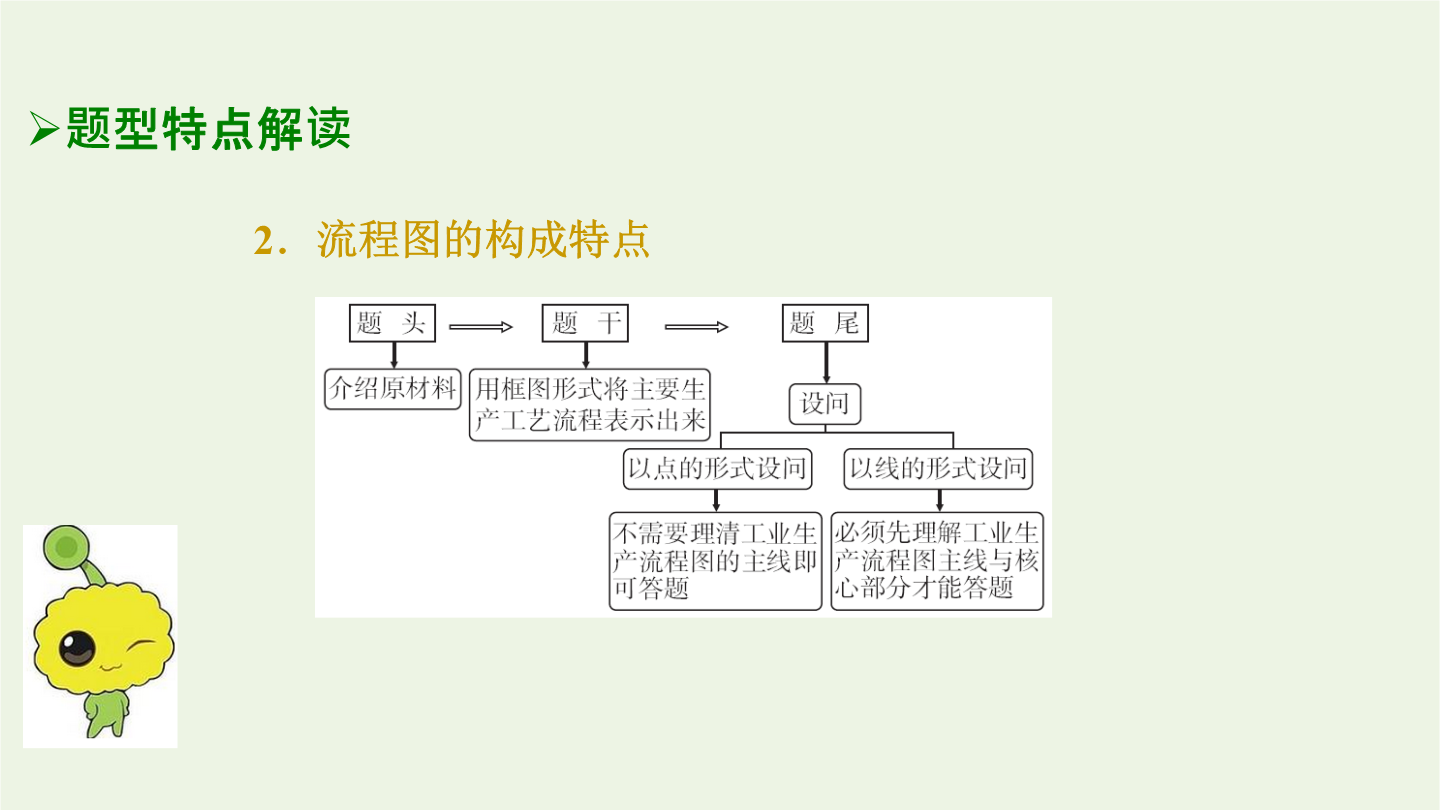
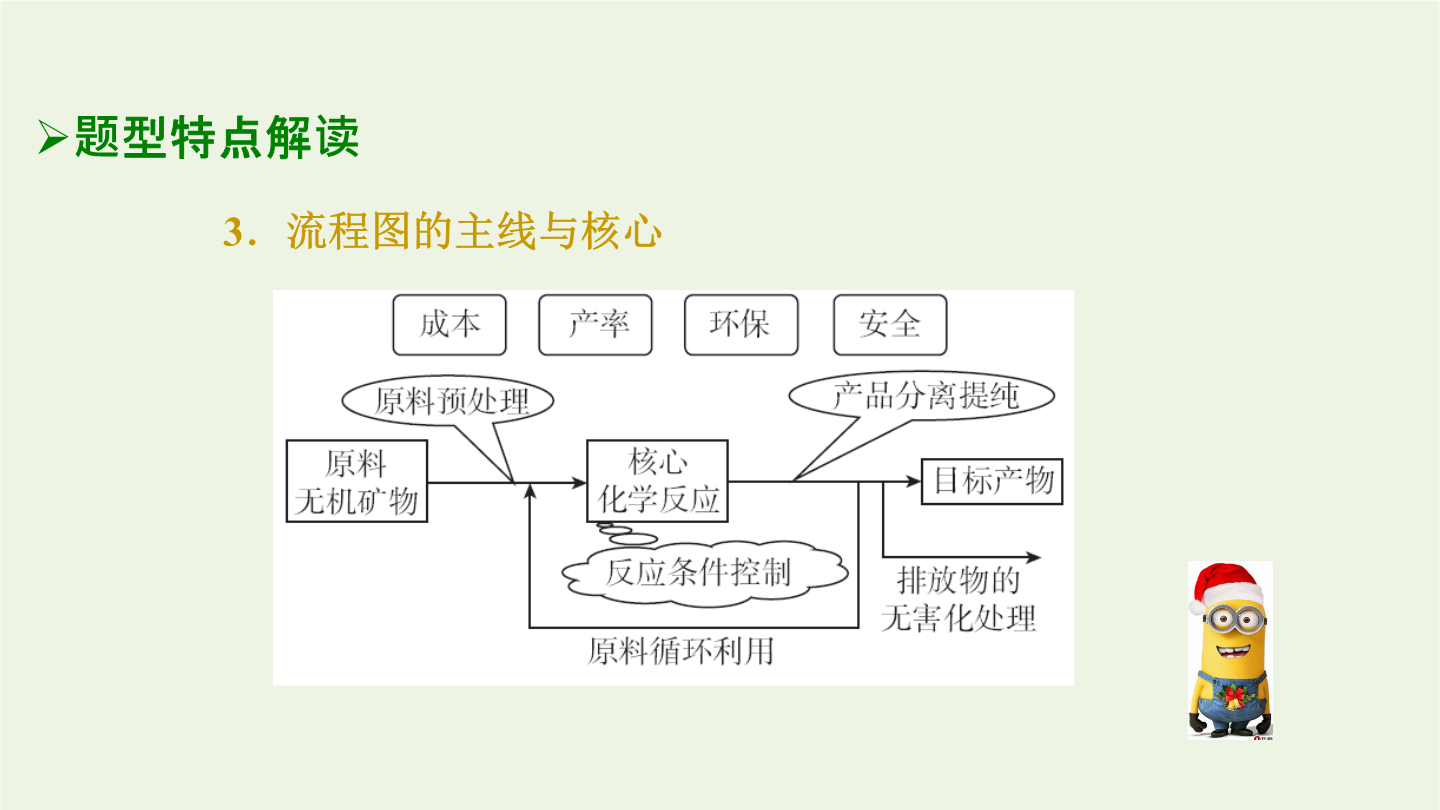
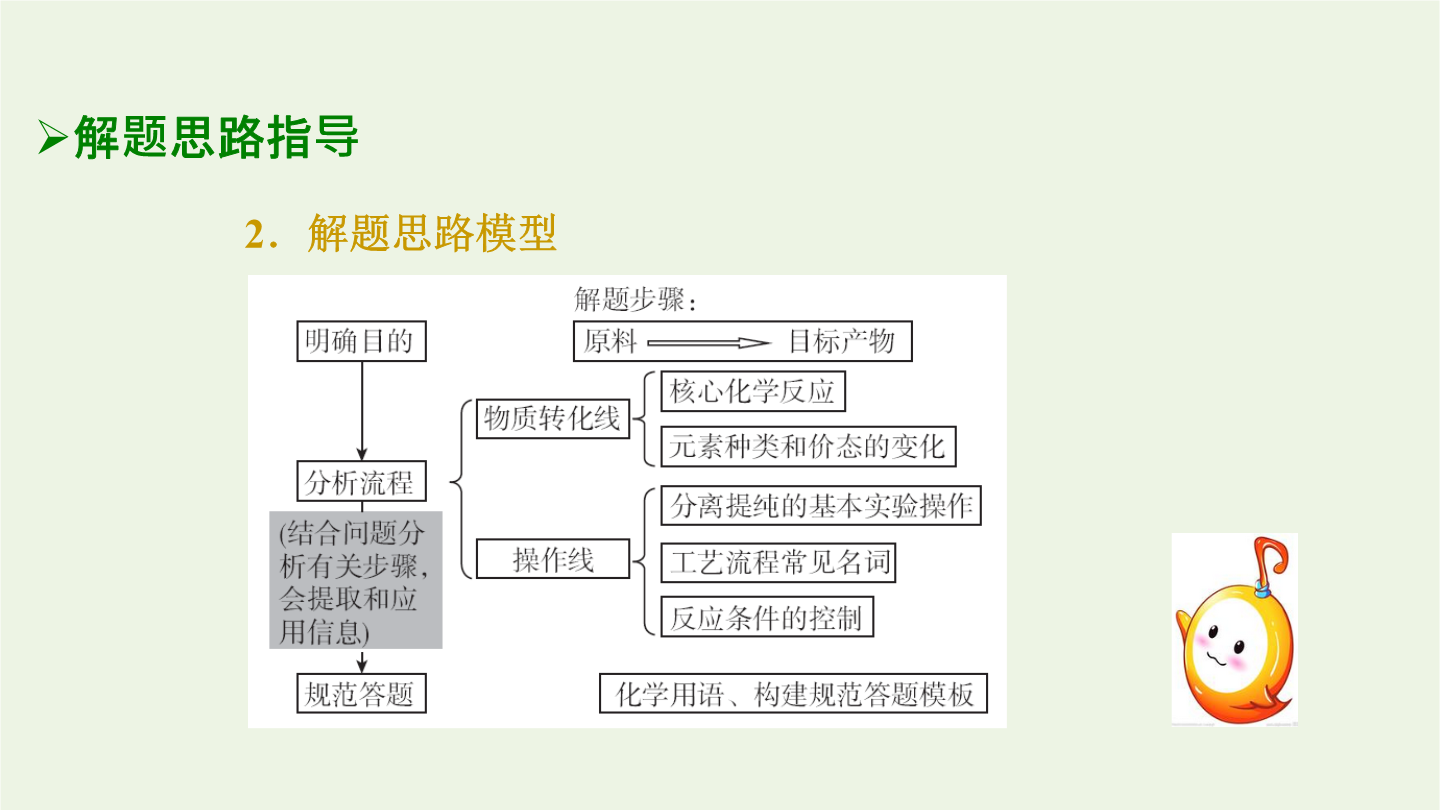
专题化学工艺流程分析题型特点解读2.流程图的构成特点3.流程图的主线与核心解题思路指导2.解题思路模型关键知识提升2.制备过程中应注意的反应条件(1)溶液的pH①控制反应的发生,增强物质的氧化性或还原性,或改变水解程度。②常用于使某些金属离子形成氢氧化物沉淀。(2)温度:根据需要选择适宜温度,改变反应速率或使平衡向需要的方向移动;减少副反应的发生;确保一定的反应速率;控制溶解度便于提纯。(3)浓度①根据需要选择适宜浓度,控制一定的反应速率,使平衡移动利于目标产物的生成,减小对后续操作产生的影响。②过量,能

2020高考化学二轮复习 专题9 化学工艺流程综合型研究课件.ppt

高考化学二轮复习 专题 化学工艺流程分析课件-人教版高三全册化学课件.pptx
专题化学工艺流程分析题型特点解读2.流程图的构成特点3.流程图的主线与核心解题思路指导2.解题思路模型关键知识提升2.制备过程中应注意的反应条件(1)溶液的pH①控制反应的发生增强物质的氧化性或还原性或改变水解程度。②常用于使某些金属离子形成氢氧化物沉淀。(2)温度:根据需要选择适宜温度改变反应速率或使平衡向需要的方向移动;减少副反应的发生;确保一定的反应速率;控制溶解度便于提纯。(3)浓度①根据需要选择适宜浓度控制一定的反应速率使平衡移动利于目标产物的生成减小对后续操作产生的影响。②过量能保证反应的

高考化学二轮复习 专题 化学工艺流程分析课件-人教版高三全册化学课件.pptx
专题化学工艺流程分析题型特点解读2.流程图的构成特点3.流程图的主线与核心解题思路指导2.解题思路模型关键知识提升2.制备过程中应注意的反应条件(1)溶液的pH①控制反应的发生增强物质的氧化性或还原性或改变水解程度。②常用于使某些金属离子形成氢氧化物沉淀。(2)温度:根据需要选择适宜温度改变反应速率或使平衡向需要的方向移动;减少副反应的发生;确保一定的反应速率;控制溶解度便于提纯。(3)浓度①根据需要选择适宜浓度控制一定的反应速率使平衡移动利于目标产物的生成减小对后续操作产生的影响。②过量能保证反应的

2020高考化学二轮复习 题型八 工艺流程题课件.pptx
题型八工艺流程题五年高考命题统计与预测题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点一题点
