
药物合成卤化反应.ppt

是雁****找我






亲,该文档总共97页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

卤化反应药物合成反应.pptx
药物合成反应10%平时成绩20%课后作业70%期末考试Or10%平时成绩20%课后作业30%期中考试40%期末考试前言目前,化学药物是临床用药的主力军,而合成药物则是化学药物的主体。药物合成是有机合成的一个重要应用分支。《药物合成反应》课程的教学目的是使学生在学习有关基础课程后能系统地掌握化学药物及其中间体制备中重要有机合成反应和合成设计原理,以利于培养学生在实际药物合成工作中能选择良好的药物合成反应、分析、确定合理的工艺条件和控制方法,设计药物合成路线,根据科学实验和生产实践,筛选、抉择药物的工艺路线,

药物合成卤化反应.ppt
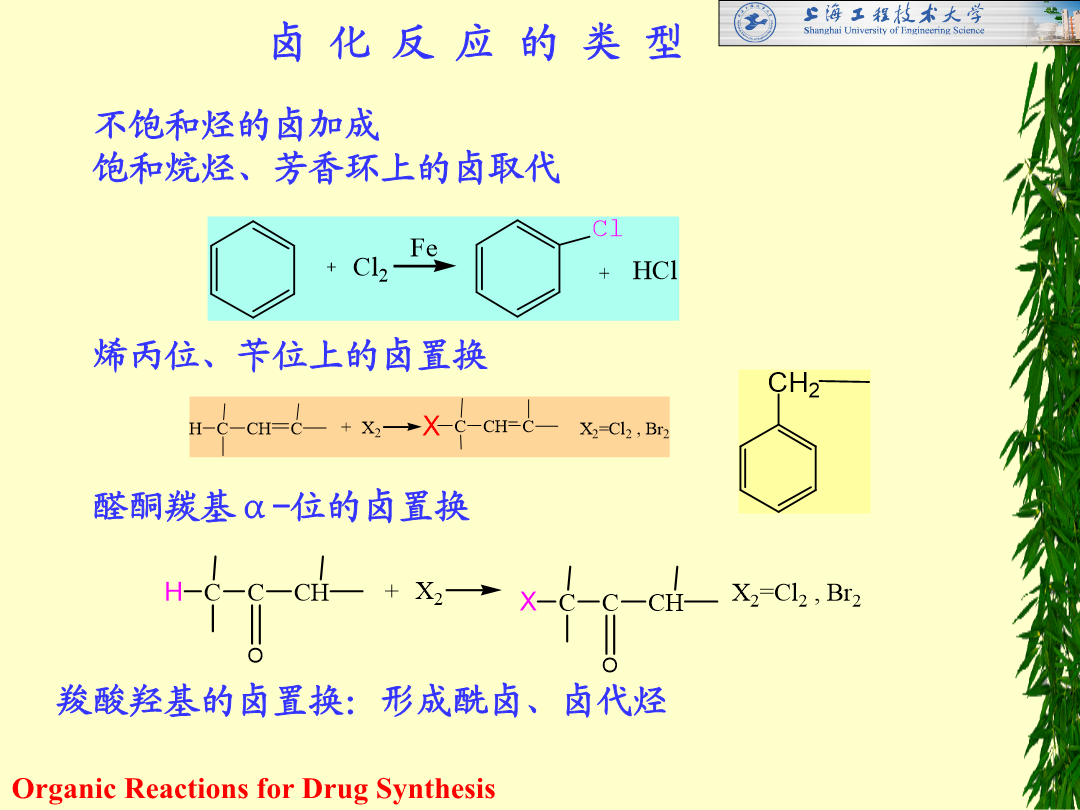
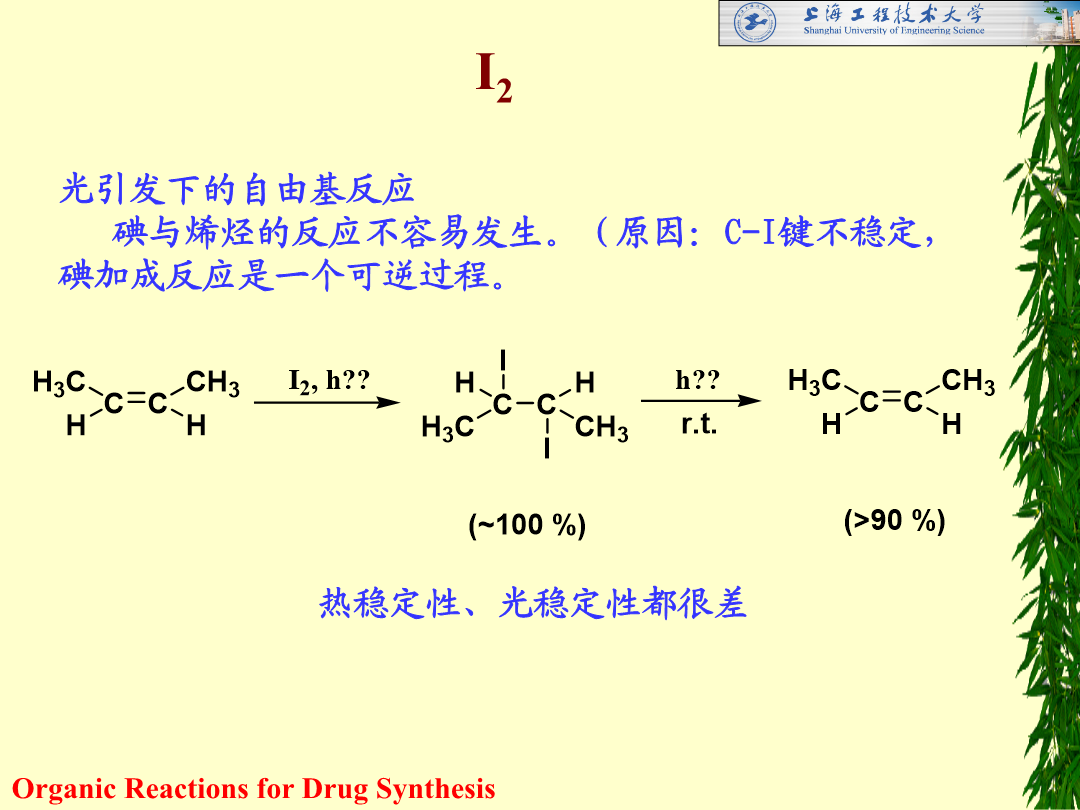
第一章卤化反应HalogenationReaction卤化反应:在有机化合物分子中建立C-X得到含卤化合物的反应工业应用:20世纪20年代以后1923年:甲烷气相氯化的工业装置建成1931年:工业生产氟氯甲烷1958年:氧化氯化法合成卤代烷现在:广泛用于有机合成制备各种重要的原料、中间体和工业溶剂卤化反应的类型不饱和烃的卤加成饱和烷烃、芳香环上的卤取代烯丙位、苄位上的卤置换醛酮羰基α-位的卤置换羧酸羟基的卤置换:

【精选】卤化反应药物合成反应gcz.ppt
药物合成反应10%平时成绩20%课后作业70%期末考试Or10%平时成绩20%课后作业30%期中考试40%期末考试前言目前化学药物是临床用药的主力军而合成药物则是化学药物的主体。药物合成是有机合成的一个重要应用分支。《药物合成反应》课程的教学目的是使学生在学习有关基础课程后能系统地掌握化学药物及其中间体制备中重要有机合成反应和合成设计原理以利于培养学生在实际药物合成工作中能选择良好的药物合成反应、分析、确定合理的工艺条件和控制方法设计药物合成路线根据科学实验和生产实践筛选、抉择

《药物合成反应》第1章 卤化反应.ppt
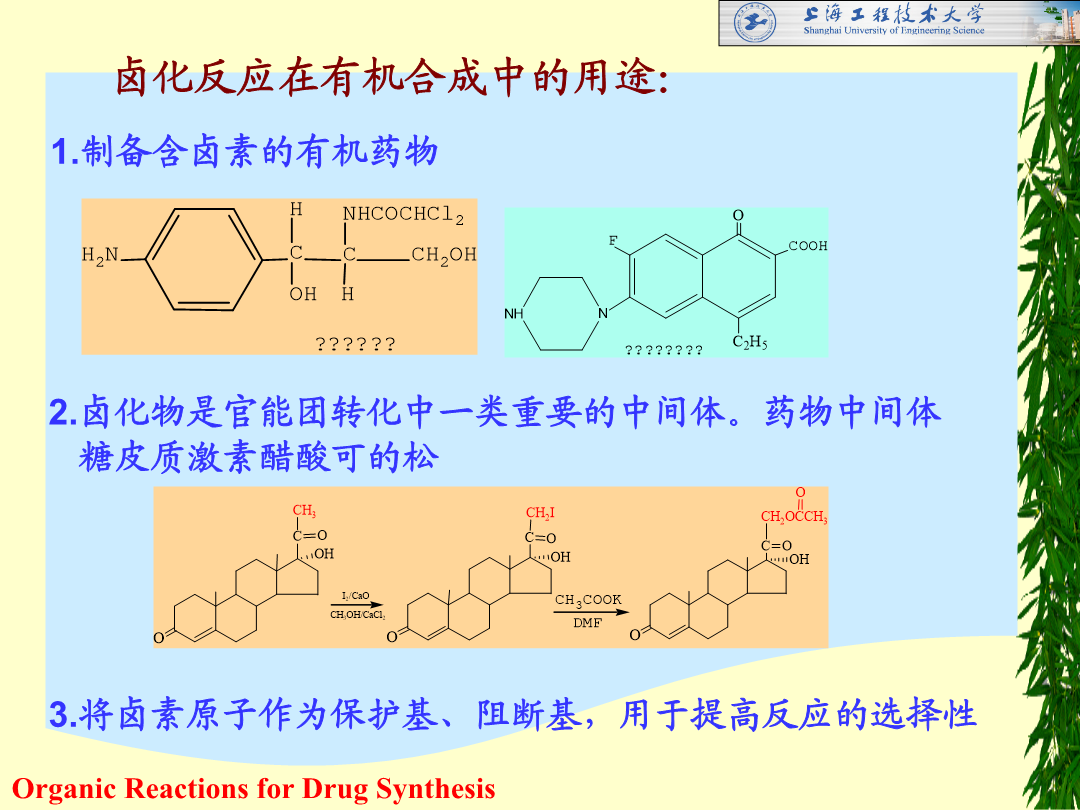
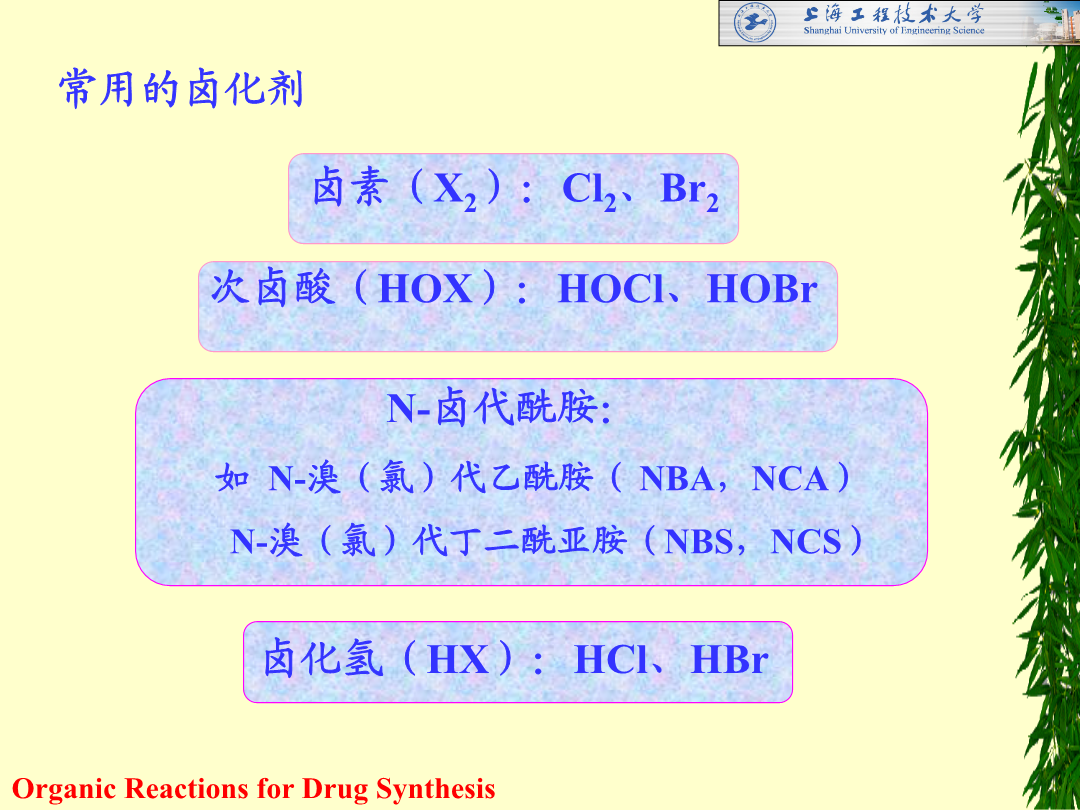
第一章卤化反应[教学内容]1.不饱和烃的卤加成反应2.烃类的卤取代反应(烯丙位、苄基位碳原子上的卤取代反应和芳烃的卤取代反应)3.醇、酚和醚的卤置换反应4.羧酸的卤置换反应5.其它官能团化合物的卤置换反应(卤素交换、磺酸脂和芳香重氮盐化合物的卤置换反应等)卤化反应的概念:向有机化合物分子中引入卤素原子(建立碳-卤键)的反应。目的:1.制备具有不同生理活性的含卤素有机药物;2.将卤化物作为中间体通过进一步转化,生成其他产品,如:糖皮质激素醋酸可的松的制备3.卤素原子作为保护基等,提高反应的选择性。常用卤化剂

【精选】药物合成反应》第1章卤化反应.ppt
第一章卤化反应[教学内容]1.不饱和烃的卤加成反应2.烃类的卤取代反应(烯丙位、苄基位碳原子上的卤取代反应和芳烃的卤取代反应)3.醇、酚和醚的卤置换反应4.羧酸的卤置换反应5.其它官能团化合物的卤置换反应(卤素交换、磺酸脂和芳香重氮盐化合物的卤置换反应等)卤化反应的概念:向有机化合物分子中引入卤素原子(建立碳-卤键)的反应。目的:1.制备具有不同生理活性的含卤素有机药物;2.将卤化物作为中间体通过进一步转化生成其他产品如
