
海水资源的开发利用.ppt

可爱****乐多









亲,该文档总共39页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

海水资源的开发利用海水资源的开发利用1.ppt
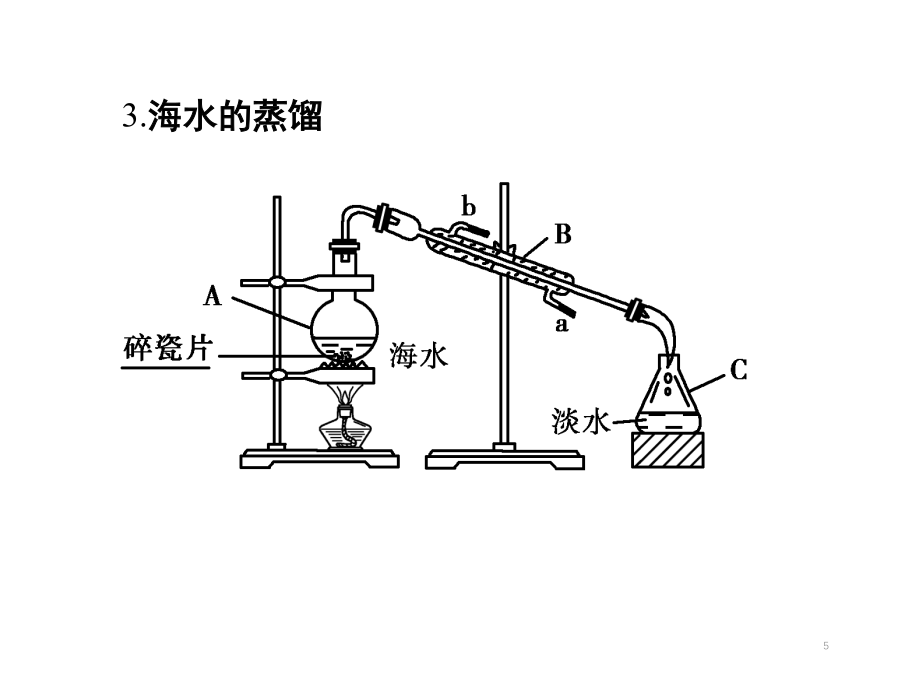
第四章化学与自然资源的开发利用从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中为什么中日在钓鱼岛问题上互不相让?海水资源的开发利用1、海水水资源的利用海水的淡化:蒸馏法所用的装置及原理太阳能蒸发海水示意图:它是利用离子交换膜的选择透过性,在直流电场的作用下使水中的离子有选择的定向迁移,使溶液中阴阳离子发生分离的一种理化过程,由于其能耗低、产水量大、脱盐率高稳定性强等特点,现已被广泛的用于医药、电子、化工、食品、硬水软化、海水淡化等方面。2、海水化学资源的开发利用煮海盐田法制得的粗盐中含较

海水资源的开发利用.ppt
海水资源的开发利用为什么中日在钓鱼岛问题上互不相让?1、海水资源(1)海水的淡化:大连石化公司海水淡化处理海水过滤器经处理后海水就变成了可以饮用的纯净的水(2)海水的综合利用从海水中提取溴2NaBr+Cl2=2NaCl+Br2Br2+SO2+2H2O=2HBr+H2SO42HBr+Cl2=2HCl+Br2证明海带中存在碘元素⑥从海水中制金属镁化学反应:a.MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2b.Mg(OH)2+2HCl=MgCl2+H2O1从海水中提取下列物质,可以不涉及到化学变化的是

海水资源开发利用.ppt
课前准备为什么中菲黄岩岛问题上互不相让?第四章化学与可持续发展学习目标学习指导一检测一1.海洋约占地球表面积.海水淡化的方法有。海水淡化就是由咸水得到淡水。蒸馏法所用的装置及原理学习指导二(2)海水的综合利用④从海水中制金属镁化学反应:a.MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2b.Mg(OH)2+2HCl=MgCl2+H2O1从海水中提取下列物质,可以不涉及到化学变化的是()AMgBNaClCBr2DK2医生建议因缺少某种元素而患甲状腺肿大的病人多食用海带,这是因为海带中含有较丰富的()

海水资源开发利用.ppt
第一节开发利用金属资源和海水资源海洋占地球表面积的71%海水中水的储存量约占地球总水量的97%。海水水资源的利用,主要包括海水的淡化和直接利用海水进行循环冷却。海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。(二)海水化学资源的开发利用从海水中提取NaCl从海带中提取碘实验过程【实验迁移】设计实验流程从海带中提取碘单质(I2)?【资料卡片】从海水中提取Br2海水综合利用联合工业体系一例海水资源的开发利用海水的综合利用可以制备金属镁,其流程如下图所示:

海水资源的开发利用.docx
第二讲海水资源的开发利用北京四中:田军丰富的海水资源海水中有80多种化学元素,如SMgHBrNaSrF等,还有鱼、虾、贝、蟹、藻类。水资源地球水资源71%地球淡水资源2.8%冰川68.7%可用淡水资源0.77%1.海水水资源的利用(1)向海洋要淡水!(2)海水循环冷却2.海水化学资源的开发利用(1)海水制盐凡盐产最不一,海、池、井、土、崖、砂石,略分六种,而东夷树叶,西戎光明不与焉。赤县之内,海卤居十之八,而其二为井、池、土碱。或假人力,或由天造。凡海水自具咸质,海滨地高者名潮墩,下者名草荡,地皆产盐。同
